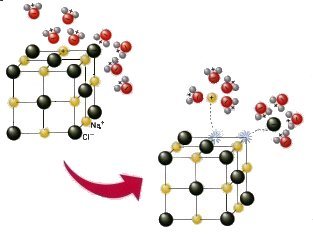
Le molecole polari hanno la proprietà di orientarsi in un campo elettrico, rivolgendo le proprie estremità cariche verso le cariche di segno opposto.
Se sciogliamo in un solvente polare (cioè formato da molecole polari, tipo H2O ) una sostanza ionica (tipo NaCl), questa sostanza si dissocia in ioni positivi e ioni negativi. Ciascuno ione crea nell’ambito delle soluzioni un campo elettrico e le molecole polari del solvente, attratte dagli ioni, si orientano e circondano ogni ione di molecole polari (dipoli). In questo caso tra le molecole polari e gli ioni si stabilisce un legame ione-dipolo.